本文汇总了子宫内膜癌靶向药多款抗癌药物的研发背景、上市情况及市场价格,涵盖免疫检查点抑制剂、PARP抑制剂等多种类型,为患者和投资者提供参考。药物名称...
2025-12-09 552 度伐利尤单抗 呋喹替尼 奥拉帕利 仑伐替尼 安罗替尼 信迪利单抗 帕博利珠单抗 贝莫苏拜单抗 免疫检查点抑制剂 PARP抑制剂 Dostarlimab

11月13日,NMPA官网最新公示,阿斯利康PD-L1抑制剂度伐利尤单抗(Durvalumab,商品名:英飞凡,Imfinzi)的新适应症申请已在中国获批。阿斯利康2023Q1财报透露,已在中国递交了度伐利尤单抗治疗胆道癌的新适应症上市申请,本次获批适应症大概率是度伐利尤单抗联合吉西他滨+顺铂治疗局部晚期或转移性胆道癌的成人患者。此前,度伐利尤单抗已在中国获批治疗非小细胞肺癌(NSCLC)和广泛期小细胞肺癌的一线治疗,也是首个在国内上市的PD-L1抗体。
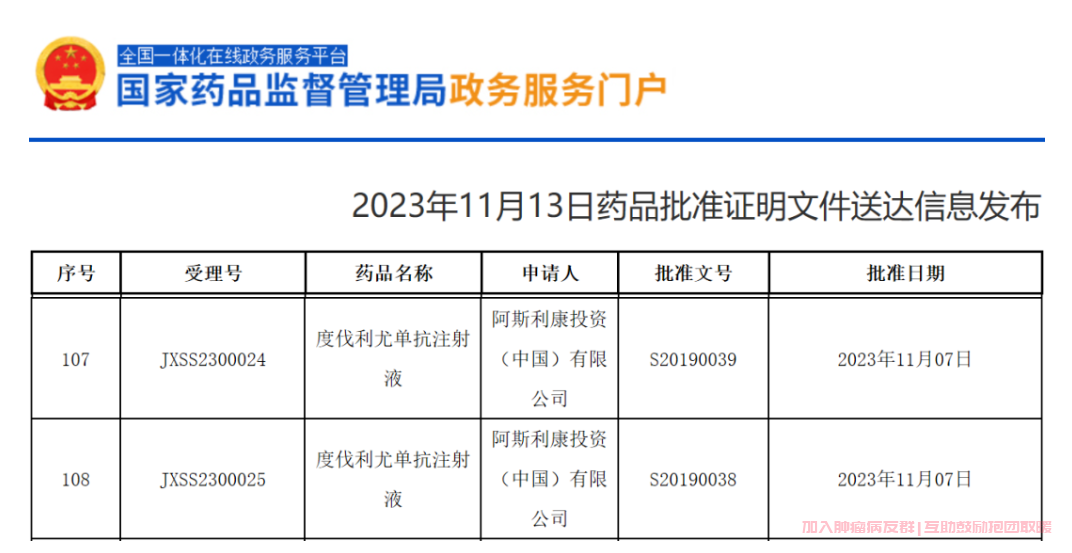 图源:NMPA官网
图源:NMPA官网胆道癌(BTC)是一组罕见的侵袭性胃肠道癌症,形成于胆管(胆管癌)、胆囊(胆囊癌)或壶腹的细胞中,胆道癌在中国和东南亚更为常见,在西方国家也呈上升趋势;胆囊癌在南美洲、印度和日本的某些地区更为常见;影响胆管和胆囊的早期BTC通常没有明确的症状,因此大多数BTC新病例在晚期才被诊断出来,此时治疗选择有限,预后较差,大约5%到15%的BTC患者存活5年。
度伐利尤单抗该适应症曾先后获得美国FDA优先审查和孤儿药称号,并于2022年9月FDA批准上市。上市基于TOPAZ-1研究结果,TOPAZ-1是一项随机、双盲、安慰剂对照、全球多中心的3期临床试验,共纳入685例组织学证实的局部晚期不可切除或转移性胆道癌患者,这些患者此前未接受过晚期疾病的全身治疗。
试验人口统计数据如下:56%亚洲人,37%白人,2%黑人,4%其他种族;7%西班牙裔或拉丁裔;男性和女性各占50%;年龄中位数为64岁,年龄范围在20-85岁之间,47%的人年龄在65岁及以上;56%为肝内胆管癌,25%为胆囊癌,19%为肝外胆管癌。
主要终点是总生存期(OS)。前24周每6周进行一次肿瘤评估,然后每8周进行一次,直到确认客观疾病进展。与随机接受安慰剂联合吉西他滨+顺铂的患者相比,随机接受Durvalumab联合吉西他滨+顺铂的患者的OS有统计学上显著的改善,与安慰剂相比,Durvalumab联合化疗降低了20%的死亡风险(随访延长至6.5个月,死亡风险降低了24%)。Durvalumab组和安慰剂组的总生存期(OS)分别为12.8个月和11.5个月;无进展生存期(PFS)分别是7.2个月和5.7个月;客观缓解率(ORR)分别为27%和19%。
安全性方面,20%的患者会出现常见的不良反应,包括:疲劳、恶心、便秘、食欲下降、腹痛、皮疹和发热。
基于TOPAZ-1的结果,Durvalumab胆道癌适应症在欧洲、日本和其他几个国家的监管申请目前也在审查中。
度伐利尤单抗于2017年5月首次在美国获批上市,用于治疗局部晚期或转移性尿路上皮癌。截至目前,该产品已在美国获批多项肿瘤适应症,包括尿路上皮癌、广泛期小细胞肺癌、胆道癌、肝细胞癌、非小细胞肺癌。
11月9日,阿斯利康宣布,在肝细胞癌(HCC)患者中,与经动脉化疗栓塞(TACE)单独治疗相比,Imfinzi(度伐利尤单抗)联用TACE和贝伐珠单抗在主要终点无进展生存期(PFS)方面具有统计学意义和临床意义的改善。
目前,度伐利尤单抗正以单药或者联合其它抗癌药物的形式,探索在小细胞肺癌、非小细胞肺癌、膀胱癌、多种消化道 (GI) 癌症、卵巢癌、子宫内膜癌和其它实体肿瘤等方向的治疗前景。
来源:新浪财经
标签: 英飞凡 度伐利尤单抗 英飞凡胆道癌获批 pdl1药 度伐利尤单抗胆道癌 胆道癌免疫治疗药物 胆道癌
相关文章

肺癌群聊答疑:非小细胞肺癌用度伐利尤单抗1000mg/3w有循证医学证据吗孔祥鸣 易加医肿瘤综合服务平台 特聘专家收治疾病: 胶质...
2025-05-12 415 度伐利尤单抗 非小细胞肺癌 肺癌群聊加入 度伐利尤单抗用药剂量 非小细胞肺癌pd1用药
小细胞肺癌病友群患者提问:请问广泛期的小细胞肺癌选择免疫治疗用什么好?价格是多少呢?许伟 枣庄市肿瘤医院 影像科收治疾病: 肺癌、...
2023-12-11 6747 度伐利尤单抗 小细胞肺癌 免疫治疗 小细胞肺癌交流群 小细胞肺癌病友交流群 阿替利珠单抗 小细胞肺癌免疫药物 小细胞肺癌免疫治疗价格 小细胞肺癌免疫治疗新进展 小细胞肺癌免疫治疗药物 斯鲁利单抗 阿得贝利单抗 PDL-1

加入肿瘤互助群
已有10万+患友进群交流经验↓
10万+真实病友交流经验,广告勿扰
打开微信,点击右上角"+"号,粘贴微信号,搜索即可!添加管理受邀进群讨论!
发表评论