2025年刚刚过半,中国抗癌战场已迎来历史性突破!国家药监局(NMPA)数据显示,仅上半年就批准23款肿瘤新药,创下同期审批数量新高!从"A...
2025-07-07 5397 抗癌药 厄达替尼片 2025抗癌新药 抗癌新药目录 艾沙妥昔单抗注射液 塞纳帕利胶囊 复妥宁 复迈宁 百赫安 艾维达 海纳安

核准日期:
2025年01月08日
修改日期:
2025年01月27日
2025年03月11日
2025年04月24日
2025年11月10日
厄达替尼片说明书
请仔细阅读说明书并在医师指导下使用
【药品名称】 通用名称:厄达替尼片
商品名称:博珂/BALVERSA
英文名称:Erdafitinib Tablets
汉语拼音:Edatini Pian
【成份】 本品活性成份为厄达替尼。
化学名称:N-(3,5-二甲氧基苯基)-N-(1-甲基乙基)-N-[3-(1-甲基-1H-毗唑-4-基) 喹喔味-6-基]乙烷-1,2-二胺
化学结构式: 分子式:
分子量:446.56
辅料:
交联羧甲纤维素钠、硬脂酸镁、甘露醇、葡甲胺、微晶纤维素、欧巴代ambⅡ 88A120003黄色(含辛癸酸甘油酯1型、聚乙烯醇-部分水解、十二烷基硫酸钠、滑石粉、二 氧化钛、黄氧化铁)或欧巴代ambIⅡ88A130001橙色(含辛癸酸甘油酯I型、聚乙烯醇-部 分水解、十二烷基硫酸钠、滑石粉、二氧化钛、黄氧化铁、红氧化铁)或欧巴代amb Ⅱ 88A165000棕色(含辛癸酸甘油酯I型、聚乙烯醇-部分水解、十二烷基硫酸钠、滑石粉、二 氧化钛、黄氧化铁、红氧化铁、黑氧化铁)。
【性状】 本品3mg 规格片剂为黄色、圆形双凸、薄膜包衣片,一面刻有“3”,另一面刻有“EF”; 4mg规格片剂为橙色、圆形双凸、薄膜包衣片,一面刻有“4”,另一面刻有“EF”;5mg规 格片剂为棕色、圆形双凸、薄膜包衣片,一面刻有“5”,另一面刻有“EF”;各规格片剂除 去包衣后,均显淡黄绿色至黄绿色。
【适应症】 本品用于携带易感型 FGFR3基因变异,且既往接受至少一线含抗PD-1或抗PD-L1期 间或之后出现疾病进展的手术不可切除的局部晚期或转移性尿路上皮癌(UC)成人患者。
【规格】 (1)3mg;(2)4mg;(3)5mg
【用法用量】 本品应在有抗肿瘤药物使用经验的医生的指导下使用。
FGFR3变异检测
在使用本品治疗前,应采用验证过的检测方法确定患者存在FGFR3变异。经医院或实 验室基因检测判断为携带有FGFR3变异的患者能接受本品治疗;应在强生公司指定的医院 或实验室使用研究性伴随诊断检测方法对患者的FGFR3基因状态进行检测。
推荐剂量
本品的推荐起始剂量为8mg,每日一次口服给药:根据血清磷酸盐水平和药物相关毒 性,符合标准的个体可将剂量上调至9mg每日一次(参见【用法用量】剂量调整)。
用药
本品应整片吞咽,可与或不与食物同服。如果在服用本品后出现呕吐,应在第二天服用 下一剂量。 继续本品治疗,直至疾病进展或出现不可接受的毒性。
药物漏用
如果漏服本品,应尽快补服。次日恢复本品每日常规给药方案。请勿额外服用本品以弥 补漏服药物。
剂量调整
血清磷酸盐(PO?)水平应在开始治疗后14至21天之间评估。如果血清磷酸盐水平< 9.0mg/dL且没有药物相关毒性,尽快将剂量上调至9mg每日一次。如果血清磷酸盐水平为 9.0mg/dL或更高,遵循表2进行相应的剂量调整。第21天后,不应根据血清磷酸盐水平来 指导剂量上调决策。
剂量降低和不良反应管理
可能的剂量降低和不良反应管理见表1至表4。
表1:本品剂量降低方案
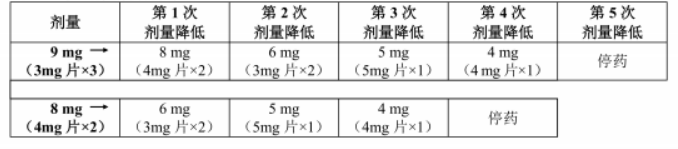
高磷酸血症管理
高磷酸血症是使用FGFR抑制剂后预期会出现的一过性实验室检查结果异常(参见【临 床药理】药效学)。应每月监测磷酸盐浓度。接受本品治疗的患者出现磷酸盐浓度升高的情 况时,应遵循表2中的剂量调整指南。如磷酸盐浓度的升高呈持续性,可考虑使用不含钙的 磷酸盐结合剂(例如碳酸司维拉姆)。
表2:上调本品剂量后根据血清磷酸盐浓度进行的剂量调整建议
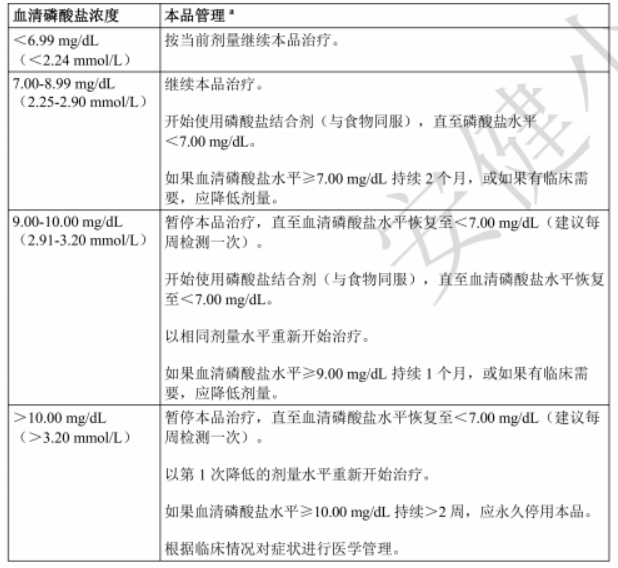

*如果磷酸盐浓度≥5.5mg/dL(1.75mmol/L),则将磷酸盐摄入严格控制在600-800 mg/天。
眼部疾病管理
开始本品治疗前,应进行基线眼科检查,包括阿姆斯勒方格表测试、眼底镜检查、视力 为了预防和治疗干眼,未睡时至少每2小时使用一次人工泪液、补水或润滑眼胶或眼 随后每月为患者进行检查,包括阿姆斯勒方格表测试,如果观察到任何异常,则遵循表
表3:本品治疗所致眼部疾病的管理指南
检查以及光学相干断层扫描(OCT)(如有)。 膏。对于治疗相关的重度干眼应由眼科医生进行评估。 3中的管理指南。 严重程度分级 本品剂量管理
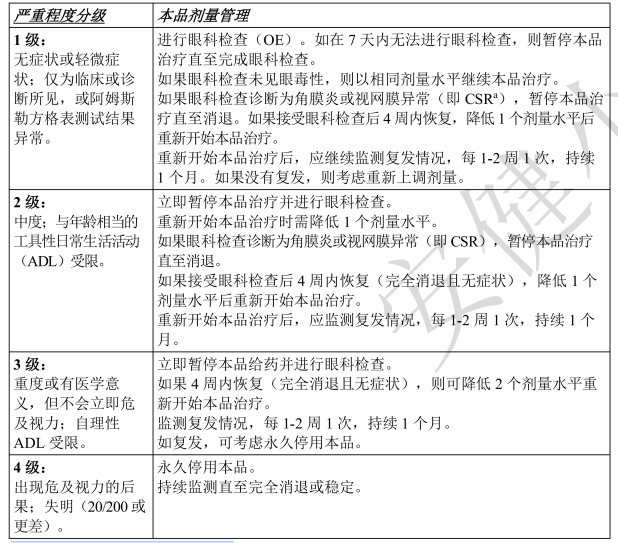
aCSR:中心性浆液性视网膜病变 出现其他不良反应时的剂量调整 使用本品时观察到指甲、皮肤和黏膜改变。遵循表4中的剂量调整指南。
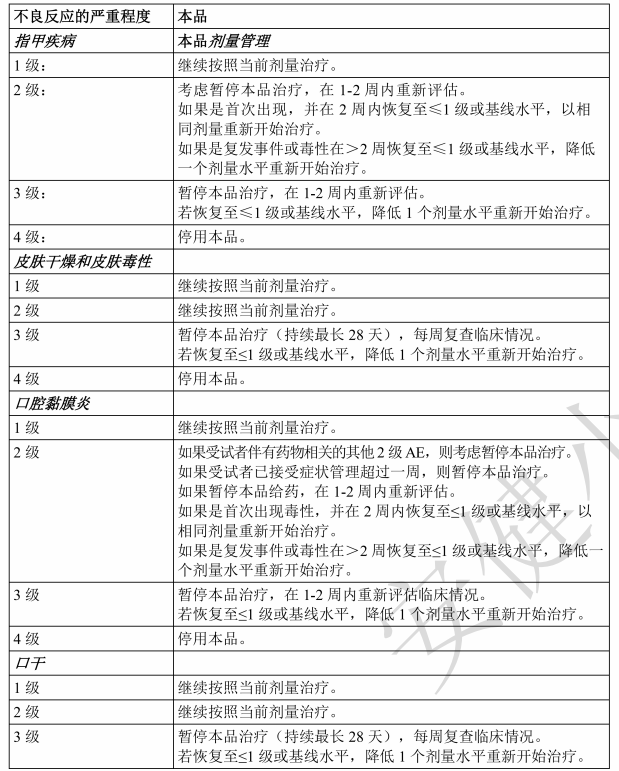
表4:针对使用本品时出现的指甲、皮肤和黏膜不良反应,建议调整剂量
特殊人群
儿童患者(17岁及以下)
尚未确定厄达替尼在儿童中的安全性和疗效。
老年患者(65岁及以上)
老年患者无需特别调整剂量(参见【临床药理】药代动力学)。
肾损害
轻度或中度肾功能损害患者无需调整剂量(参见【临床药理】药代动力学)。重度肾功 能损害患者的数据有限。
肝损害
轻度或中度肝功能损害患者无需剂量调整(参见【临床药理】药代动力学)。重度肝功 能损害患者的数据有限。
【不良反应】 安全性特征概要
最常见的不良反应为高磷酸血症(78.5%)、腹泻(55.5%)、口腔黏膜炎(52.8%)、口干(39.9%)、食欲减退(31.7%)、皮肤干燥(28.0%)、中心性浆液性视网膜病变(28.0%)、贫血(28.2%)、便秘(27.3%)、味觉倒错(26.3%)、掌跖红肿综合征(PPES)(25.5%)、脱发(23.2%)、虚弱(23.0%)、丙氨酸氨基转移酶升高(21.7%)、指甲剥离(21.7%)、疲劳(20.3%)、恶心(18.6%)、体重降低(18.4%)、天门冬氨酸氨基转移酶升高(18.0%)、干眼(16.7%)、指甲变色(15.9%)、呕吐(13.8%)、血肌酐升高(13.8%)、低钠血症(13.4%)、甲沟炎(12.5%)、指甲营养不良(11.9%)、脱甲(11.5%)、鼻衄(10.6%)、指甲疾病(10.2%)和腹痛(10.0%)。最常见的3级药物不良反应(ADR)为口腔黏膜炎(10.6%)、低钠血症(8.8%)、掌跖红肿综合征(7.9%)、指甲剥离(4.8%)、腹泻(4.0%)、高磷酸血症(2.9%)、食欲减退(2.5%)和指甲营养不良(2.5%)。65岁及以上患者与<65岁患者相比,3级或4级有关的治疗期间不良事件(TEAE)(47.6%vs.43.5%)和有关严重不良事件(14.6%vs.10.5%)的报告频率更高。59.7%的患者发生了导致剂量降低的不良反应。口腔黏膜炎(15.4%)、掌跖红肿综合征(9.6%)、指甲剥离(7.3%)和高磷酸血症(5.2%)是导致剂量降低的最常见不良事件。19.4%的患者因不良反应而终止治疗。视网膜色素上皮层脱离(1.7%)和口腔黏膜炎(1.5%)是导致治疗终止的最常见不良事件。
不良反应列表 安全性特征是基于临床研究中接受本品治疗的479 例不可切除的局部晚期或转移性尿 路上皮癌患者的汇总数据。患者接受本品治疗的起始剂量为8mg/9mg,口服给药每日一次。 治疗持续时间中位数为4.8个月(范围:0.1-43.4个月)。 下文表按发生率类别列出了在临床研究期间观察到的不良反应。发生率类别定义如下: 十分常见(≥1/10);常见(≥1/100至<1/10);偶见(≥1/1000至<1/100);罕见(≥1/10,000 至<1/1000);十分罕见(<1/10,000)。 肝损害 每个发生率类别下的不良反应按严重程度降序排列。
表5:临床研究中发现的不良反应
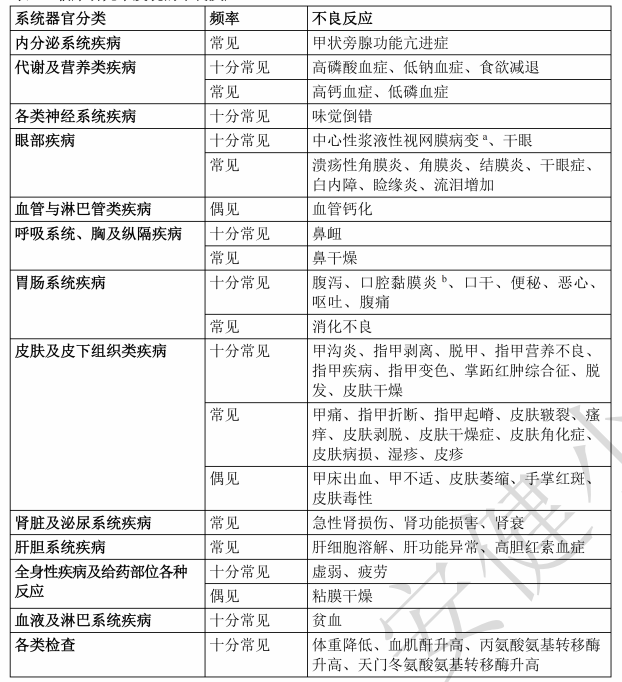
“ 中心性浆液性视网膜病变包括视网膜脱离、玻璃体分离、视网膜水肿、视网膜病、脉 络膜视网膜病变、视网膜色素上皮层脱离、视网膜黄斑色素上皮细胞脱落、黄斑脱 离、浆液性视网膜脱离、视网膜下积液、视网膜增厚、视网膜脉络膜炎、浆液性视网 膜病、黄斑病变、脉络膜渗漏、视物模糊、视觉损害、视力减退。
b 口腔黏膜炎包括口腔溃疡。
选定不良反应的描述
中心性浆液性视网膜病变(CSR)
31.5%的患者报告了CSR不良反应,至首次发生任何级别事件的中位时间为51天(参见[注意事项])。最常报告的事件为视物模糊、脉络膜视网膜病变、视网膜色素上皮(RPE)脱离、视力减退、视觉损害、视网膜脱离、视网膜病和视网膜下积液。2.7%的患者报告了3级或4级CSR。大多数中心性浆液性视网膜病变事件发生在治疗的前90天内。截至数据着止日期,43.0%的患者的CSR已消退。在CSR患者中,11.3%的患者暂停给药,14.6%的患者降低剂量。3.3%的患者因以下原因停用本品:RPE脱离(1.7%)、脉络膜视网膜病变(0.6%)视力减退(0.6%)、黄斑病变(0.4%)、视物模糊(0.2%)、视觉损害(0.2%)、视网膜脱离(0.2%)和视网膜下积液(0.2%)。
其他眼部疾病
36.3%的患者报告了眼部疾病(中心性浆液性视网膜病变除外)。最常报告的事件为干眼(16.7%)、结膜炎(9.8%)和流泪增加(9.2%)。在发生不良事件的受试者中,4.8%的受者降低剂量,6.7%的受试者暂停给药。1.3%的受试者因眼部疾病而停用厄达替尼。至首次发生眼部疾病的中位时间为53天(参见[注意事项])。
指甲疾病
62.6%的患者报告了指甲疾病。最常报告的事件包括指甲剥离(21.7%)、指甲变色(15.9%)、甲沟炎(12.5%)、指甲营养不良(11.9%)和脱甲(11.5%)。指甲疾病的发生率在暴露第1个月之后升高。至发生任何级别指甲疾病的中位时间为63天。
皮肤病变
54.5%的患者报告了皮肤病变。最常报告的事件为皮肤干燥(28%)和掌跖红肿综合征(25.5%)。至发生任何级别皮肤病变的中位时间为47天。
胃肠系统疾病
83.9%的患者报告了胃肠系统疾病。最常报告的事件为腹泻(55.5%)、口腔黏膜炎(52.8%和口干(39.9%)。至发生任何级别胃肠疾病的中位时间为15天。
高磷酸血症和软组织矿化
厄达替尼可引起高磷酸血症。磷酸盐浓度升高是使用本品后预期会出现的一过性药效学效应(参见[临床药理]药效学)。78.5%接受本品治疗的患者报告了高磷酸血症不良事件。在厄达替尼治疗早期报告了高磷酸血症,其中1-2级事件普遍发生在最初的3或4个月内,3纱事件发生在第1个月内。至发生任何级别高磷酸血症事件的中位时间为16天。在0.2%接受本品治疗的患者中观察到了血管钙化(参见[用法用量])。分别在6.1%和2.9%的接受本品治疗的患者中观察到了高钙血症和甲状旁腺功能亢进症(参见[用法用量]表2)。
低磷血症
厄达替尼可引起低磷血症。5.6%的患者发生了低磷血症。1.0%的患者发生3-4级低磷血症。至发生3级事件的中位时间为140天。这些事件均为非严重事件,均未导致停药或剂量降低。0.2%的患者暂停给药。
实验室检查结果异常
53.4%的患者的实验室检查结果异常(高磷酸血症除外,已单独描述)。最常报告的实验室检查异常为贫血(28.2%[135例患者]:至发生事件的中位时间为44天,38.5%[52/135]己消退)、丙氨酸氨基转移酶升高(21.7%[104例患者];至发生事件的中位时间为41天;75%[78/104]已消退)、天门冬氨酸氨基转移酶升高(18%[86例患者];至发生事件的中位时间为37天;73.3%[63/86]已消退)、血肌酐升高(14.2%[68例患者];至发生事件的中位时间为57天:44.1%[30/68]已消退)和低钠血症(13.4%[64例患者]:至发生事件的中位时间为55天:51.6%[33/64]已消退)。
[禁忌]
无。
[注意事项]
眼部疾病
开始本品治疗前,应进行基线眼科检查,包括阿姆斯勒方格表测试、眼底镜检查、视力检查以及光学相干断层扫描(OCT)(如有)。
本品可引起眼部疾病,包括中心性浆液性视网膜病变(CSR)(一种组合术语,包括视网膜色素上皮脱离[RPED]),导致视野缺损(参见[注意事项]对驾驶和操作机器能力的影响和[不良反应])。与<65岁患者(28.8%)相比,65岁患者(33.3%)的中心性浆液性视网膜病变的总体发生率更高。与<65岁患者(2.1%)相比,65岁受试者(6.3%)的RPED事件发生率更高。对于65岁患者以及患有具有临床意义的眼器官疾病(例如视网膜疾病,包括但不限于中心性浆液性视网膜病变、黄斑/视网膜变性、糖尿病性视网膜病和既往视网膜脱离)的患者,建议对其进行密切的临床监测(参见[不良反应])
在本品治疗期间,16.7%的患者出现干眼症状,0.3%的患者为3级或4级(参见[不良反应])。所有患者应在清醒时至少每2小时接受一次干眼预防治疗或眼用缓和剂(例如人工泪液、保湿或润滑眼凝胶或软膏)治疗。对于治疗相关的重度千眼应由眼科医生进行评估。在治疗的前4个月内每月进行一次眼科检查(包括阿姆斯勒方格表测试),之后每3个月进行一次眼科检查,并在出现视觉症状时随时进行紧急检查(参见[用法用量])。如果观察到任何异常,请遵循表3中的管理指南。眼科检查应包括视力评估、裂隙灯检查、眼底镜检查和光学相干断层扫描。对于发生眼部不良事件后重新开始本品治疗的患者,应进行包括临床眼科检查在内的密切监测。
当发生CSR时,暂停本品治疗,如果事件在4周内未消退或严重程度为4级,则永久停药。对于眼部不良反应,请遵循剂量调整指南(参见[用法用量]眼部疾病管理)。
高磷酸血症
本品可引起高磷酸血症。长期高磷酸血症可导致软组织矿化、皮肤钙质沉着、非尿毒症性钙化防御症、低钙血症、贫血、继发性甲状旁腺功能亢进症、肌肉痛性痉挛、癫痫发作、QT间期延长和心律失常。在本品治疗早期报告了高磷酸血症,大多数事件发生在前3-4个
月内,3级事件发生在第1个月内。
在整个治疗过程中监测高磷酸血症。当血清磷酸盐水平5.5mg/dL时,应严格限制膳食中的磷酸盐摄入(每天600-800mg),并应避免合并使用可能增加血清磷酸盐水平的药物(参见[用法用量])。不建议接受厄达替尼治疗的患者补充维生素D,否则可能导致血清磷酸盐和钙水平升高。
如果血清磷酸盐高于7.0mg/dL,考虑加用口服磷酸盐结合剂,直至血清磷酸盐水平恢复至<7.0mg/dL。按照表2(参见[用法用量]),根据高磷酸血症的持续时间和严重程度,考虑暂停、降低剂量或永久停用本品。
与已知可延长QT间期的药物联用本品与已知可延长QT间期的药物或可能诱发尖端扭转性室性心动过速的药物联用时应谨慎,例如IA类(如奎尼丁、丙吡胺)或III类(如胺碘酮、索他洛尔、伊布利特)抗心律失常药、大环内酯类抗生素、选择性5-羟色胺再摄取抑制剂(如西酞普兰、艾司西酞普兰)、美沙酮、莫西沙星和抗精神病药(如氟哌啶醇和硫利达嗪)。
低磷血症
本品治疗期间可能发生低磷血症。应在本品治疗期间和治疗中断期间监测血清磷酸盐水平。如果血清磷酸盐水平低于正常值,应停止降磷治疗和膳食磷酸盐限制(如适用)。重度低磷血症可能表现为意识模糊、癫痫发作、局灶性神经系统体征、心脏衰竭、呼吸衰竭、肌无力、横纹肌溶解和溶血性贫血。剂量调整参见[用法用量]。1.0%的患者的低磷血症反应为3-4级。
指甲疾病
接受本品治疗时,指甲疾病(包括指甲剥离、指甲变色和甲沟炎)十分常见(参见[不良反应])。
应监测患者的指甲毒性体征和症状。应建议患者进行预防性治疗,如良好卫生习惯、按需使用非处方甲增强剂,并监测感染体征。应根据表4,基于厄达替尼有关毒性,停用本品或调整本品治疗。
皮肤病变使用本品治疗时,皮肤病变十分常见,包括皮肤干燥、掌跖红肿综合征(PPES)、脱发和瘙痒(参见[不良反应])。应对患者进行监测,并提供支持性治疗,如避免不必要的日晒和过度使用肥皂及沐浴。患者应定期使用保湿剂,避免使用香水产品。应根据表4,基于厄达替尼有关毒性,停用本品或调整本品治疗。
光敏反应
由于可能存在与本品治疗有关的光毒性反应风险,在日晒时应注意穿着防晒衣并/或涂抹防晒霜。
黏膜疾病
接受本品治疗时,口腔黏膜炎和口干十分常见(参见[不良反应])。应建议患者在症状恶化时就医。应监测患者并提供支持性治疗,如良好的口腔卫生、按需每天使用3次或4次小苏打漱口水以及避免食用辛辣和/或酸性食物。应根据表4,基于厄达替尼有关毒性,停用本品或调整本品治疗。
实验室检查
接受本品治疗的患者曾报告肌酐升高、低钠血症、转氨酶升高和贫血(参见[不良反应])。
在本品治疗期间应定期进行全血细胞计数和血清生化检查,以监测这些变化。
生殖及发育毒性
根据作用机制和动物生殖研究的发现,厄达替尼具有胚胎毒性和致畸性(参见[药理毒理])。应告知妊娠女性本品对胎儿的潜在风险。应建议有生育能力的女性患者在治疗前、治疗期间以及末次给药后1个月内采取高效的避孕措施(参见[孕妇及哺乳期妇女用药])。应建议男性患者在本品治疗期间和末次给药后!个月内使用有效的避孕措施(例如避孕套),并且不得捐献或储存精液(参见[孕妇及哺乳期妇女用药])。
建议有生育能力的女性在开始本品治疗前进行高敏感度的妊娠检查。与强效或中效CYP2C9或CYP3A4抑制剂联用
本品与中效CYP2C9或强效CYP3A4抑制剂联用时,需要调整剂量(参见[药物相互作用])。
与强效或中效CYP3A4诱导剂联用
不建议本品与强效CYP3A4诱导剂联用。本品与中效CYP3A4诱导剂联用时,需要调整剂量(参见[药物相互作用])。
与激素类避孕药联用
与本品联用可能会降低激素类避孕药的有效性。应建议服用激素类避孕药的患者在本品治疗期间和末次给药后1个月内使用不受酶诱导剂影响的替代避孕方法(例如,非激素宫内节育器)或其他非激素避孕方法(例如,避孕套)(参见[药物相互作用]和[孕妇及哺乳期妇女用药])。
具有已知作用的辅料
每片薄膜包衣片的钠含量小于1mmol(23 mg),即基本上"不含钠"。对驾驶及操作机械能力的影响
本品对驾驶和操作机器的能力有一定的影响。在FGFR抑制剂和本品治疗中观察到了眼部疾病,如中心性浆液性视网膜病变或角膜炎。如果患者出现影响视力的治疗相关症状,建议其不要驾驶或操作机器,直到症状消退(参见[注意事项]眼部疾病)。
[孕妇及哺乳期妇女用药]
妊娠
尚无可用的关于厄达替尼相关风险的人体数据。根据动物生殖研究的结果,孕妇使用厄达替尼会对胎儿造成损害。在大鼠胚胎-胎仔毒性研究中,在暴露量低于所有研究剂量的人体暴露量时,厄达替尼具有胚胎毒性和致畸性(参见[用法用量])。胎仔毒性的特征是手/足缺陷和某些大血管(例如主动脉)畸形。
如果在妊娠期间使用本品,或患者在服用本品期间怀孕,应告知患者本品对胎儿的潜在危害,并就其临床和治疗选择向患者提供咨询。建议患者如果在接受本品治疗期间以及治疗后1个月内怀孕或疑似怀孕,应联系医务人员。哺乳
尚无数据显示人乳汁中出现厄达替尼,或说明本品对母乳喂养婴儿或乳汁分泌的影响。由于本品可能导致母乳喂养的婴儿出现严重不良反应,建议女性在本品治疗期间以及末次用药后1个月内不要哺乳。
妊娠检查
建议有生育能力的女性在开始本品治疗前进行高敏感度的妊娠试验。
避孕
孕妇使用本品可能会对胎儿造成损害。告知有生育能力的女性患者在本品治疗前和治疗期间以及末次用药后1个月内使用高效避孕措施。男性患者在本品治疗期间和末次用药后1个月内必须使用有效的避孕措施(例如避孕套),并且不得捐献或储存精液。生育力
尚无相关数据可以确定本品对男性或女性生育力的潜在影响。
[儿童用药]
尚未确定厄达替尼在儿童中的安全性和疗效。
[老年用药]
未观察到老年患者与较年轻成人患者之间存在安全性或有效性的总体差异(参见[临床药理]药代动力学)。
[药物相互作用]
其他药物对本品的影响
中效CYP2C9抑制剂或强效CYP3A4抑制剂
与中效CYP2C9或强效CYP3A4抑制剂联合用药会增加厄达替尼的暴露量,可能导致药物相关毒性增加。考虑使用无或极轻度酶抑制作用的替代药物。如果本品与中效CYP2C9或强效CYP3A4抑制剂联合用药,可根据耐受性降低本品剂量(参见[用法用量])。如果停
用中效CYP2C9或强效CYP3A4抑制剂,可根据耐受性调整本品剂量。
强效或中效CYP3A4诱导剂
与卡马西平(一种强效CYP3A4和弱效CYP2C9诱导剂)联合用药会导致厄达替尼暴露量降低(参见[临床药理]药代动力学)。避免本品与强效CYP3A4诱导剂联合用药。如果在本品治疗开始时必须同时给予中效CYP3A4诱导剂,则按9mg每日一次的剂量进行本品给药。如果停用中效CYP3A4诱导剂,则在没有药物相关毒性的情况下,以相同剂量继续接受本品。
本品对其他药物的作用
P糖蛋白(P-gP)底物
本品与P-gp底物联合用药可能会增加这些药物的全身暴露量(参见[临床药理]药代动力学)。口服治疗指数窄的P-gp底物(如地高辛)应在厄达替尼给药前或给药后至少6小时服用,以尽量降低发生药物相互作用的可能性。
[药物过量]
症状和体征
无本品用药过量的信息。
治疗
对于本品用药过量,无已知的特定解毒剂。如果发生用药过量,请停用本品,采取一般支持性措施,直至临床毒性减轻或消退。
[药物过量]
症状和体征
无本品用药过量的信息。
治疗
对于本品用药过量,无已知的特定解毒剂。如果发生用药过量,请停用本品,采取一般支持性措施,直至临床毒性减轻或消退。[临床药理]
作用机制
参见[药理毒理]
药效学
心脏电生理学
基于对187名癌症患者进行的开放性、剂量递增和剂量扩展研究中QTe间期的评估,厄达替尼对QTe间期没有大的影响(即>20ms)。
血清磷酸盐
厄达替尼使血清磷酸盐浓度升高,这是FGFR抑制作用的一种药效学生物标记物。在每日一次连续给药的治疗早期,血清磷酸盐浓度5.5mg/dL可提高临床应答(参见[用法用量])。
药代动力学
以下数据均来自国外临床研究。群体药代动力学研究中纳入了中国大陆受试者的稀疏PK数据。
单次和每日一次重复给药后,厄达替尼暴露量(最大血药浓度[Cmss]和药时曲线下面积[AUC])在0.5mg-12mg剂量范围内随剂量成比例增加。每日一次给药2周后达到稳态,平均蓄积比为4倍。8mg每日一次给药(拟定起始剂量)后,厄达替尼稳态Cmas、AUC,和最小血药浓度(Cmm)的均值(变异系数[CV%])分别为1399ng/mL(50.8%),29,268ng.h/mL(59.9%)和936ng/mL(64.9%)。厄达替尼血浆浓度的每日波动较小,每日一次给药后稳态时的峰谷比均值(CV%)为1.47(23%)。
吸收
单次口服给药后,中位达峰时间(tmax)为2.5小时(范围:2-6小时)并且口服后几乎完全吸收。
食物的影响
健康受试者在空腹和高脂肪膳食条件下接受厄达替尼给药后,Cmas和AUC未出现具有临床意义的变化。随餐服用后,中位达峰时间(tms)延迟了约1.5小时(参见[用法用量]).
分布
厄达替尼在癌症受试者中的平均表观分布容积为28.8L。
在癌症受试者中,厄达替尼与人血浆蛋白(首选与a1-酸性糖蛋白[AGP]结合)的结合率为99.7%。
消除
厄达替尼在患者体内的平均总表观清除率(CL/F)为0.362L/h。
厄达替尼在患者体内的平均有效半衰期为58.9小时。
代谢
代谢是厄达替尼的主要消除途径.厄达替尼在人体内主要经CYP2C9和CYP3A4代谢,形成O-去甲基化的主要代谢物。估计CYP2C9和 CYP3A4对厄达替尼总清除率的贡献分别为39%和20%。厄达替尼原型药是血浆中的主要药物相关形态,没有循环代谢物。
排泄
单次口服放射性标记的["C]-厄达替尼16天后,经粪便和尿液回收的剂量分别为69%(14%-21%为厄达替尼原型药)和19%(13%为厄达替尼原型药)。
特殊人群
在不同年龄(21岁-92岁)、性别、种族(白种人、西班牙裔或亚洲人)、体重(36kg-166 kg)、轻度或中度肾功能损害和轻度或中度肝功能损害患者中,未观察到厄达替尼的药代动力学存在具有临床意义的差异。
儿童
未在儿童患者中考察厄达替尼的药代动力学。
肾功能损害
在肾功能正常(cGFR-MDRD[肾病膳食改良方法估算的肾小球滤过率]90mL/min/1.73m2)、轻度肾功能损害(eGFR-MDRD为60至89mL/min/1.73m2)和中度肾功能损害(eGFR-MDRD为30至59mL/min/1.73m2)的受试者中,未观察到厄达替尼的药代动力学存在具有临床意义的差异。
肝功能损害
基于PK分析,在轻度肝功能损害(Child-PughA)或中度肝功能损害(Child-Pugh B)受试者和肝功能正常受试者中,未观察到厄达替尼的药代动力学存在具有临床意义的差异。
CYP2C9弱代谢者
CYP2C9*1/*2和*1/*3基因型受试者中的厄达替尼暴露量与野生型受试者相当,在模拟中获得了相似的结果。没有其他基因型(例如,*2/*2,*2/*3和*3/*3)受试者的数据。模拟结果显示,CYP2C9*2/*2和*2/*3受试者的厄达替尼暴露量未发生具有临床意义的变化。预计CYP2C9*3/*3基因型受试者的厄达替尼暴露量增加50%,估计这些基因型受试者在各族群组人群中占0.4%-3%,这也是各种异质性2C9弱代谢者人群的最坏条件情况。
药物相互作用研究
临床研究
其他药物对本品的作用
中效CYP2C9抑制剂
与氟康唑(一种中效CYP2C9和CYP3A4抑制剂)联合用药后,本品的Cmsw和AUCmr相较于本品单药治疗的均值比分别为121%和148%。
强效CYP3A4抑制剂
与伊曲康唑(一种强效CYP3A4抑制剂和 P-gp抑制剂)联合用药后,本品的Cms和AUCimr相较于本品单药治疗的均值比分别为105%和134%。
CYP3A4/2C9诱导剂
与卡马西平(一种强效CYP3A4诱导剂和弱效CYP2C9诱导剂)联合用药后,本品的Cmw和AUCinr相较于本品单药治疗的均值比分别为78%和45%。
本品对其他药物的作用
CYP3A4 底物
与本品联合用药后,未观察到对咪达唑仑(CYP3A4底物)暴露量产生有临床意义的影
响。
OCT2底物
与本品联合给药后,未观察到对二甲双胍(一种OCT2底物)暴露量产生有临床意义的影响。
体外研究
CYP底物
厄达替尼是CYP3A4的时间依赖性抑制剂和诱导剂。在临床相关浓度下,厄达替尼不是其他主要CYP同工酶的抑制剂。
转运蛋白
厄达替尼是P-gP的底物和抑制剂。预计P-gp抑制剂不会影响厄达替尼暴露量至临床相关程度。厄达替尼是OCT2的抑制剂。
在临床相关浓度下,厄达替尼不抑制 BCRP、OATPIB.OATPIB3、OAT1,OAT3,OCT1、MATE-I或MATE-2K
抑酸药
厄达替尼在1至7.4的pH范围内具有足够的溶解度。预期抑酸药(包括抗酸剂、Hz拮抗剂和质子泵抑制剂)不会影响厄达替尼的生物利用度。
遗传药理学
参见[临床药理]药代动力学"CYP2C9弱代谢者"。
[临床试验]
项III期、随机、开放性、多中心研究BLC3001的队列1评价了本品的疗效,评估携带特定FGFR变异的晚期(不可切除或转移性)尿路上皮癌患者接受厄达替尼与化疗(多西他赛或长春氟宁)的总生存期(OS),这些患者既往接受一线或二线治疗后出现疾病进展,且其中至少有一线包括在不可切除的局部晚期或转移性尿路上皮癌治疗时使用程序性死亡受体-1(PD-1)或程序性死亡配体-1(PD-L1)抑制剂(抗PD-(L)1)。
接受新辅助或辅助(化疗或免疫疗法)治疗的患者,如果在末次给药后12个月内出现疾病进展,则被视为在转移阶段接受了系统性治疗。本研究排除了过去3个月内患有未得到控制的心血管疾病或存在2级(481ms)QTe间期延长且伤口愈合延迟的患者,以及存在任何级别中心性浆液性视网膜病变或视网膜色素上皮脱离的患者。
主要疗效数据基于266例既往接受过抗PD-(L)l治疗且随机接受厄达替尼(8mg,如果血清磷酸盐水平<9.0mg/dL且无药物相关毒性,则将个体剂量上调至9mg)或化疗(多西他赛75mg/m2,每3周一次,或长春氟宁320mg/m2,每3周一次)的患者。
在研究中,入组患者必须携带至少1种以下FGFR融合:FGFR2-BICC1、FGFR2-CASP7、FGFR3-TACC3、FGFR3-BAIAP2L1;或携带至少1种以下FGFR3基因突变:R248C、S249C、G370C、Y373C。使用中心实验室(74.6%)或当地实验室(25.4%)FGFR结果确定了分子学入选资格。中心实验室使用QiagenTherascreen"FGFR RGQRT-PCR试剂盒检测了肿瘤样本的FGFR基因变异。当地实验室既往对肿瘤或血液样本的检测采用的是当地实验室二代测序(NGS)检测方法。在根据当地检测入组且有肿瘤样本可用于确认检测的患者(数量有限)中,使用中心实验室检测方法进行检测得出的符合率为75.6%。
在研究队列中,99.2%的患者携带FGFR基因变异(2例受试者未携带FGFR变异;80.8%的患者携带 FGFR3突变,16.5%的患者携带FGFR3融合,1.9%的患者同时携带FGFR3突变和融合)。在该研究队列中未观察到携带FGFR2变异的患者。携带易感型FGFR3基因变异是指肿瘤携带至少一种以下FGFR融合:FGFR3-TACC3、FGFR3-BAIAP2Ll;或至少一种以下FGFR3基因突变:R248C、S249C、G370C、Y373C。该研究队列中所有携带FGFR变异的患者均至少携带1种FGFR3变异。FGFR3-S249C是最常见的变异(46.6%),其次是FGFR3-Y373C(16.9%)和FGFR3-TACC3融合(9.8%)。
厄达替尼和化疗治疗组的人口统计学特征均衡。完整研究筛选时患者中位年龄为67岁(范围:32-86岁)。大多数患者为65岁或以上:19.9%为65-69岁:19.9%为70-74岁:21.1%为75岁或以上。大多数患者为男性(71.4%)、白种人(54.1%)、来自欧洲(60.9%)。
所有患者均患有移行细胞癌,其中一小部分(5.3%)患者组织学变异组分较少(<总体的50%)。33.5%的患者的原发性肿瘤位置为上尿路,66.5%为下尿路。患者的基线ECOG评分为0分(42.9%)、1分(47.7%)或2分(9.4%)。
所有患者既往均接受过至少一线抗癌治疗,且其中必须包括抗PD-(L)1。最常接受的抗PD-(L)1治疗包括帕博利珠单抗(pembrolizumab,35.3%)、阿维鲁单抗(avelumab,22.2%)和阿替利珠单抗(atezolizumab,19.5%)。未要求既往接受过化疗,但大多数患者(89.1%)既往接受过至少一线化疗。几乎所有患者均接受过含铂化疗(厄达替尼组 89.7%,化疗组85.4%):最常使用的是顺铂(厄达替尼组55.9%,化疗组45.4%),其次是卡铂(厄达替尼组27.2%,化疗组31.5%)。
主要疗效终点是总生存期(OS)。由研究者根据RECIST(实体瘤疗效评价标准11版)评估影像学缓解,直至疾病进展、出现不可耐受的毒性、撤回同意或研究者决定终止治疗,或研究结束(以先发生者为准)。纳入无进展生存期(PFS)、客观缓解率(ORR)和缓解持续时间作为次要疗效终点。
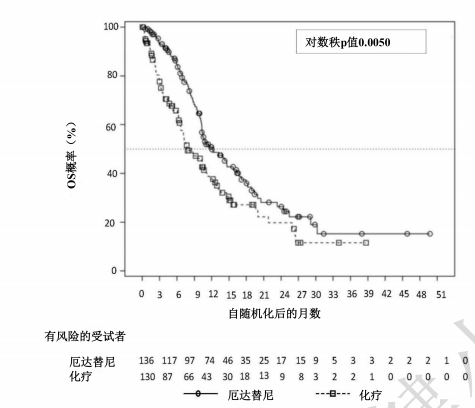
接受厄达替尼治疗的患者的OS出现具有统计学意义的改善,与化疗相比,厄达替尼延长了OS(中位OS分别为12.1个月和7.8个月)(见表6)。疗效结果总结见表6。
表6: 研究 BLC3001队列1的疗效结果概述
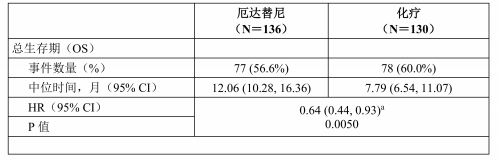
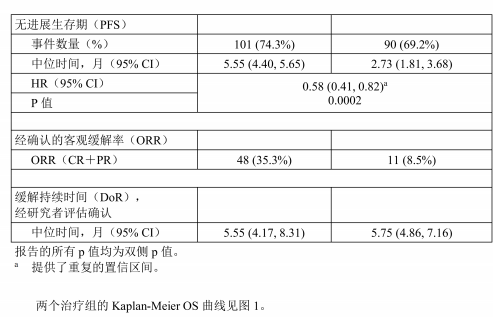
图1: 总生存期的Kaplan-Meier图-未分层分析(BLC3001研究队列1)
[药理毒理]
药理作用
厄达替尼是一种FGFR酪氨酸激酶抑制剂,体外可结合并抑制FGFR1、FGFR2、FGFR3和FGFR4酶活性。厄达替尼还可与 RET、CSFIR、PDGFRA、PDGFRB、FLT4、KIT和VEGFR2结合。厄达替尼可抑制FGFR磷酸化和信号传导,降低表达FGFR基因突变(包括点突变、扩增和融合)的细胞系存活力。厄达替尼在表达FGFR的细胞系和多种肿瘤(包括膀胱癌)异种移植模型中均具有抗肿瘤活性。
毒理研究
遗传毒性
厄达替尼细菌回复突变(Ames)试验、体外TK6细胞微核试验、大鼠体内骨髓微核试验结果均为阴性。
生殖毒性
厄达替尼未进行生育力研究,大鼠3个月重复给药毒性试验中,厄达替尼在低于人体最大推荐剂量的人体暴露量(AUC)水平时,雌性动物可见卵巢黄体坏死。
大鼠胚胎-胎仔毒性研究中,妊娠大鼠在器官形成期经口给予厄达替尼,4mg/kg/天(母体总暴露量小于人体最大推荐剂量总人体暴露量的0.1%)剂量时,可导致胚胎-胎仔死亡、主要血管畸形和其他血管异常、四肢畸形(缺指/趾畸形,缺少或畸形长骨)、多个骨骼组织(椎骨、躯干、肋骨)骨骼异常发生率增加以及胎仔体重降低。
致癌性
厄达替尼尚未进行致癌性研究。
[贮藏]
不超过25C保存。请将本品放在儿童不能接触的地方。
[包装]
本品采用高密度聚乙烯瓶包装,配有聚丙烯儿童安全盖。
3mg:56片/瓶/盒:4mg:28片/瓶/盒:5mg:28片/瓶/盒。
[有效期]
48个月
[执行标准]
药品注册标准:JX20240166
[批准文号]
3mg:国药准字HJ20250007
4mg:国药准字HJ20250008
5mg:国药准字HJ20250009
[上市许可持有人]
名称:Janssen-Cilag International NV
注册地址:Turhoutseweg 30, B-2340 Beerse, Belgium
[生产企业]
企业名称:Janssen-Cilag SpA
生产-地址址: Via C. Janssen, Borgo San Michele, 04100 Latina, Italy
[境内责任人]
名称:西安杨森制药有限公司
注册地址:陕西省西安市高新区草堂科技产业基地草堂四路19号,陕西省西安市高新区高新五路4号汇诚国际17F
邮政编码:710304
电话号码:4008889988
传真号码:(029)82576616

加入肿瘤互助群
已有10万+患友进群交流经验↓
10万+真实病友交流经验,广告勿扰
打开微信,点击右上角"+"号,粘贴微信号,搜索即可!添加管理受邀进群讨论!
发表评论